向我國境內出口第二類、第三類醫療器械的境外生產企業,應當由其在我國境內設立的代表機構或者指定我國境內的企業法人作為代理人,向國務院食品藥品監督管理部門提交注冊申請資料和注冊申請人所在國(地區)主管部門準許該醫療器械上市銷售的證明文件。
一、適用范圍
本指南適用于進口醫療器械首次注冊審批的申請和辦理
二、項目信息
(一)項目名稱:進口醫療器械注冊審批
(二)子項名稱:進口醫療器械首次注冊審批
(三)審批類別:行政許可
(四)項目編碼:30017
三、辦理依據
《醫療器械監督管理條例》(國務院令第650號)第十一條:申請第二類醫療器械產品注冊,注冊申請人應當向所在地省、自治區、直轄市人民政府食品藥品監督管理部門提交注冊申請資料。申請第三類醫療器械產品注冊,注冊申請人應當向國務院食品藥品監督管理部門提交注冊申請資料。向我國境內出口第二類、第三類醫療器械的境外生產企業,應當由其在我國境內設立的代表機構或者指定我國境內的企業法人作為代理人,向國務院食品藥品監督管理部門提交注冊申請資料和注冊申請人所在國(地區)主管部門準許該醫療器械上市銷售的證明文件。第二類、第三類醫療器械產品注冊申請資料中的產品檢驗報告應當是醫療器械檢驗機構出具的檢驗報告;臨床評價資料應當包括臨床試驗報告,但依照本條例第十七條的規定免于進行臨床試驗的醫療器械除外。
四、受理機構
國家食品藥品監督管理總局醫療器械技術審評中心
五、決定機構
國家食品藥品監督管理總局
六、審批數量
無數量限制
七、辦事條件
申請人應為境外生產企業,且該醫療器械已在注冊申請人注冊地或者生產地址所在國家(地區)已獲準上市銷售。
八、申請材料
(一)申請材料清單
表一:醫療器械注冊申報資料要求及說明
申報資料一級標題 | 申報資料二級標題 |
1.申請表 |
|
2.證明性文件 |
|
3.醫療器械安全有效基本要求清單 |
|
4.綜述資料 | 4.1概述 4.2產品描述 4.3型號規格 4.4包裝說明 4.5適用范圍和禁忌癥 4.6參考的同類產品或前代產品的情況(如有) 4.7其他需說明的內容 |
5.研究資料 | 5.1產品性能研究 5.2生物相容性評價研究 5.3生物安全性研究 5.4滅菌和消毒工藝研究 5.5有效期和包裝研究 5.6動物研究 5.7軟件研究 5.8其他 |
6.生產制造信息 | 6.1 無源產品/有源產品生產過程信息描述 6.2生產場地 |
7.臨床評價資料 |
|
8.產品風險分析資料 |
|
9.產品技術要求 |
|
10.產品注冊檢驗報告 | 10.1注冊檢驗報告 10.2預評價意見 |
11.說明書和標簽樣稿 | 11.1說明書 11.2最小銷售單元的標簽樣稿 |
12.符合性聲明 |
|
注冊申報資料應有所提交資料目錄,包括申報資料的一級和二級標題。每項二級標題對應的資料應單獨編制頁碼。
境外申請人應當提交:
1.境外申請人注冊地或生產地址所在國家(地區)醫療器械主管部門出具的允許產品上市銷售的證明文件、企業資格證明文件。
2.境外申請人注冊地或者生產地址所在國家(地區)未將該產品作為醫療器械管理的,申請人需要提供相關證明文件,包括注冊地或者生產地址所在國家(地區)準許該產品上市銷售的證明文件。
3.境外申請人在中國境內指定代理人的委托書、代理人承諾書及營業執照副本復印件或者機構登記證明復印件。
表二:體外診斷試劑注冊申報資料要求及說明
| 第三類產品 | 第二類產品 |
1.申請表 | ∨ | ∨ |
2.證明性文件 | ∨ | ∨ |
3.綜述資料 | ∨ | ∨ |
4.主要原材料的研究資料 | ∨ | △ |
5.主要生產工藝及反應體系的研究資料 | ∨ | △ |
6.分析性能評估資料 | ∨ | ∨ |
7.陽性判斷值或參考區間確定資料 | ∨ | ∨ |
8.穩定性研究資料 | ∨ | ∨ |
9.生產及自檢記錄 | ∨ | ∨ |
10.臨床評價資料 | ∨ | ∨ |
11.產品風險分析資料 | ∨ | ∨ |
12.產品技術要求 | ∨ | ∨ |
13.產品注冊檢驗報告 | ∨ | ∨ |
14.產品說明書 | ∨ | ∨ |
15.標簽樣稿 | ∨ | ∨ |
16.符合性聲明 | ∨ |
|
注:申請人應當根據產品類別按照上表要求提交申報資料。
∨:必須提供的資料。
△:注冊申請時不需要提供,由申報單位保存,如技術審評需要時提供。
境外申請人應提交:
1.申請人注冊地或者生產地址所在國家(地區)醫療器械主管部門出具的允許產品上市銷售的證明文件和可以合法生產申報產品的資格證明文件,如該證明文件中有產品類別描述,其類別應當覆蓋申報產品。
2.申請人注冊地或者生產地址所在國家(地區)未將該產品作為醫療器械管理的,申請人需要提供相關證明文件,包括注冊地或者生產地址所在國家(地區)準許該產品上市銷售的證明文件。
3.申請人符合注冊地或者生產地址所在國家(地區)醫療器械質量管理體系要求或者通過其他質量管理體系認證的證明文件。
4.申請人在中國境內指定代理人的委托書、代理人承諾書及營業執照副本復印件或者機構登記證明副本復印件。
(二)申請材料提交
申請人可通過窗口報送、郵寄等方式提交材料。
九、申請接收
(一)接收方式
1.窗口接收;
2.郵寄接收。
接收部門:國家食品藥品監督管理總局行政受理服務大廳
接收地址:北京市西城區宣武門西大街28號大成廣場3門一層
郵政編碼:100053
聯系電話:010-88331866
電子郵箱:slzx@sfda.gov.cn
(二)對外辦公時間:上午:9:00—11:30 下午:13:00—16:00
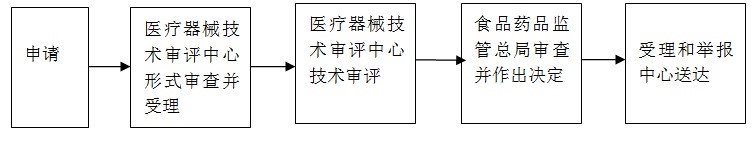
十、辦理基本流程
十一、辦理方式
(一)進口醫療器械首次注冊
(二)進口體外診斷試劑首次注冊
1.受理:
申請人按照本《指南》第八條要求,向國家食品藥品監督管理總局行政受理服務大廳提出申請,受理人員根據申報事項按照《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》(2014年第43號)、《關于印發境內第三類和進口醫療器械注冊審批操作規范》、《關于公布體外診斷試劑注冊申報資料要求和批準證明文件格式的公告》(2014年第44號)的要求對申報資料進行形式審查。
申請事項屬于本部門職權范圍,申報資料齊全、符合形式審查要求的,予以受理;申報資料存在可以當場更正的錯誤的,允許申請人當場更正;申報資料不齊全或者不符合形式審查要求的,在5個工作日內一次告知申請人需要補正的全部內容,逾期不告知的,自收到申報資料之日起即為受理;申請事項不屬于本部門職權范圍的,即時告知申請人不予受理。
2.審查:
受理人員自受理之日起3個工作日內將申報資料轉交技術審評機構。
技術審評機構應當在60個工作日內完成第二類醫療器械注冊的技術審評工作,應當在90個工作日內完成第三類醫療器械注冊的技術審評工作。
需要外聘專家審評、藥械組合產品需與藥品審評機構聯合審評的,所需時間不計算在內,技術審評機構應當將所需時間書面告知申請人。質量管理體系核查的時間和申請人補充資料的時間,不計算在審評時限內。
3.許可決定:
國家食品藥品監督管理總局應當在技術審評結束后20個工作日內作出決定,對符合安全、有效要求的,準予注冊。對不予注冊的,應當書面說明理由,并同時告知申請人享有申請復審和依法申請行政復議或者提起行政訴訟的權利。
4.送達:
自作出審批決定之日起10個工作日內,總局行政事項受理服務和投訴舉報中心將行政許可決定送達申請人。
十二、審批時限
1.受理:5個工作日;
2.行政許可決定:20個工作日(不含技術審評和申請人補充資料及補充資料審評所需的時間)。20個工作日內不能做出決定的,經總局領導批準,可延長10個工作日。
十三、審批收費依據及標準
(一)收費環節:受理
(二)收費項目:進口醫療器械首次注冊
(三)收費依據:國家發展改革委《關于重新發布中央管理的食品藥品監督管理部門行政事業性收費項目的通知》(財稅〔2015〕2號)和《關于印發〈藥品、醫療器械產品注冊收費標準管理辦法〉的通知》(發改價格〔2015〕1006號),《國家食品藥品監督管理總局關于發布藥品、醫療器械產品注冊收費標準的公告》(2015年第53號)。
(四)收費標準:進口第二類收取費用21.09萬元;進口第三類收取費用30.88萬元。
十四、審批結果
中華人民共和國醫療器械注冊證、中華人民共和國醫療器械注冊證(體外診斷試劑)
十五、結果送達
自作出審批決定之日起10個工作日內,總局行政事項受理服務和投訴舉報中心將行政許可決定送達申請人。
十六、申請人權利和義務
(一)依據《中華人民共和國行政許可法》,申請人依法享有以下權利:
1.依法取得行政許可的平等權利;
2.對行政機關實施行政許可,享有陳述權、申辯權;
3.依法申請行政復議或者提起行政訴訟;
4.合法權益因行政機關違法實施行政許可受到損害的,有權依法要求賠償。
(二)根據《醫療器械注冊管理辦法》第三十六條,受理注冊申請的食品藥品監督管理部門對不予注冊的,應當書面說明理由,并同時告知申請人享有申請復審和依法申請行政復議或者提起行政訴訟的權利。
(三)依據《中華人民共和國行政許可法》、《醫療器械注冊管理辦法》,申請人依法履行以下義務:
1.對申請材料實質內容的真實性負責;
2.依法開展取得行政許可的活動;
3.如實向負責監督檢查的行政機關提供有關情況和材料。
十七、咨詢途徑
(一)窗口咨詢;
(二)電話咨詢;
(三)電子郵件咨詢;
(四)信函咨詢。
咨詢部門:國家食品藥品監督管理總局行政受理服務大廳
通訊地址:北京市西城區宣武門西大街28號大成廣場3門一層
郵政編碼:100053
聯系電話:010-88331776
電子郵箱:slzx@sfda.gov.cn
十八、監督和投訴渠道
部門名稱:國家食品藥品監督管理總局行政事項受理服務和投訴舉報中心
地址:北京市海淀區蓮花池東路39號西金大廈七層
郵編:100036
電話:12331
十九、辦公地址和時間
(一)辦公地址: 北京市西城區宣武門西大街28號大成廣場3門一層
(二)對外辦公時間:上午:9:00—11:30 下午:13:00—16:00
(三)乘車路線:
地鐵: 地鐵2號線長椿街站D出口,往西799米即到。或地鐵7號線廣安門內站A出口,往北893米即到。
公交: 乘坐56路,78路,395路,423路在槐柏樹街西口下車,步行222米即到。乘坐42路,46路,49路,691路在天寧寺橋東下車,步行252米即到。乘坐26路,390路,395路,423路,456路,662路,691路在西便門下車,步行263米即到。
二十、公開查詢
可通過網站http://www.cfda.gov.cn/WS01/CL0135/查詢審批狀態和結果。
(食品藥品監督管理總局2016年05月05日發布)